溶液与冻融电势
溶液与冻融电势--摘自冰川冻土-1987第四期

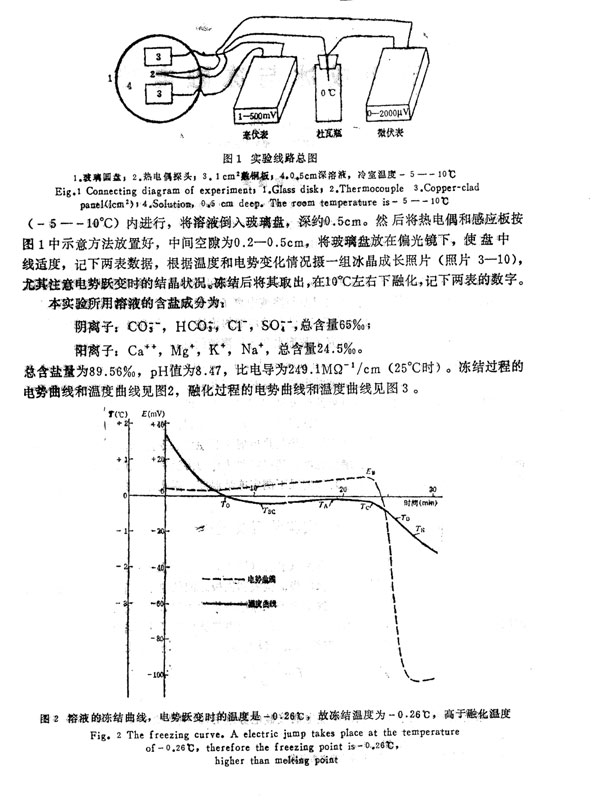
化。非零的初始电势是铜和溶液接触的电极电位,我们所用的溶液呈碱性,其定性解释
见铜一水体系的电位一pH图。随着溶液的冷却电势在缓慢上升(图2),当溶液
达Tse时电势并未发生变化,仍沿原趋势发展。当溶液温度在传统上被用作判断冻结温
度的TA-TC段变化时,仍未改变原来的发展趋势。我们知道,当溶液结晶开始后,溶
液升温从而限制了其它尚未结晶部分的冻结速度,使相变界面不能迅速迁移。经过一段
滞后,新冰晶的抽吸作用使作热运动的液态分子排列到冰晶格上,.完成了从无序向有序
的转变,便显示出一些宏观上的表征──电势的跃变,即是电势曲线上与温度曲线上r.
点相对应的EB点。电势跃变可认为是溶液完成由微观结晶到宏观结冰的标志。
电势跃变的原因。一是盐分浓度在冻结面上发生急剧突变,这种突变造成浓度梯度
电势,二是极化冰的瞬时形成。冰水界面形成过程中,存在着离子的选择问题.原始电
势使界面能从溶液中固定一种符号的电荷,当界面移动时,该电荷就被冻在其中,这样
便可形成一种新的电荷层。电势的降低就是空间的正负电荷层在相边界上所形成的电势
突变。冰相电荷增长的速率是由冰中阳离子和阴离子分布系数、溶质进入冰晶的速率、
溶液中的离子分布、冻结速率等因素共同决定的。它是冻结过程中水分子、离子、杂质
等在长程力和短程力作用下的综合运动结果。Seidenstick和Longinc曾把冰水界面
作为半导体来处理,进一步指出。水极化在界面上产生负电荷OH---,氧原子和相邻的
质子形成界面上的正电荷H3O+。
三、在融化情况下的推广
在某压强下冰要在一定的温度下才开始融化,在融化过程中温度保持不变,吸收
79.56 x 4.18J/g的融化潜热.融化的实质是水分子由规则排列转向无规则排列的过程,
即由远程有序转化为远程无序。融化热是破坏冰的点阵结构所需要的能量。只有当冰晶
体吸收的热能大于晶体结合能时,水分子才脱离点阵结构而作热运动。但理论上的融化
温度的稳定点在实验中很难测出,只有在环境温度稍高于融点(0.5℃以内)才有可能
出现稳定的融点。但在融化温度未知的情况下要做到这一点是相当困难的,况且既使有
稳定点的出现,也存在着和在冻结过程中确定冻结温度所遇到的同样问题。为了测定融
化温度,我们将电势法推广到融化情况。
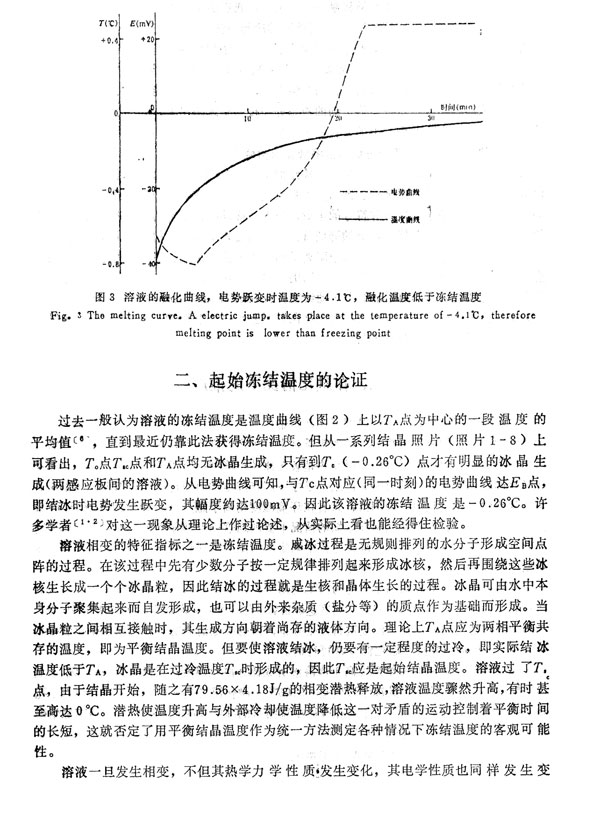
将溶液已结成的冰拿到温度约为10℃的温室中,观察其融化数据(图3)。当冰温
达-0.41℃时,电势发生跃变,其幅度达65mv左右.电势之所以发生如此大的跃变,
是因为冰相变为液相,盐分浓度重新发生分布,冰的极化消失所致。此冰的融化温度是
-0.41C。可见用此法测融化温度是可行的。
实验表明,溶液的冻结温度高于该溶液所成冰之融化温度。用NaCl溶液重复了上
述实验,仍有同样结论,其冻结温度是-2.65℃,融化温度是-4.33℃。该结论与多孔
介质中東缚水的情况相反.关于多孔介质中束缚水的冻结和融化及受外力作用下冻结融
化的情况,笔者另有较详细的论述。
致谢。本实验得到李军同志的帮助,谨致谢意.

|